商品描述:
商品属性
商品描述:
商品属性
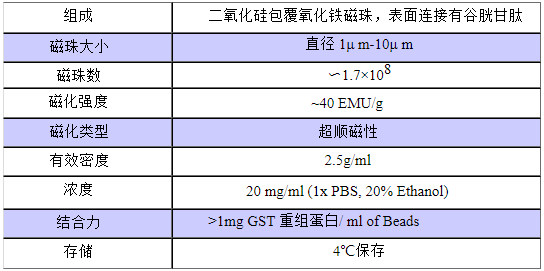
GST Magnetic Beads商品属性:
产品名称
规格
货号
GST Magnetic Beads
1ml(20mg/ml)
BJ-PJ6384
商品介绍:产品介绍:
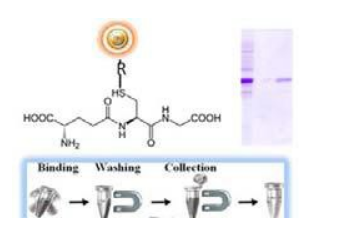
GST Magnetic Beads 是1μm大小均匀的,表面包覆有高密度谷胱甘肽的二氧化硅基质超顺磁磁珠。这种磁珠是特定设计主要用于免疫沉淀反应,或者快速,一步法纯化带有 GST-标签的重组蛋白,纯化过程大约需要15-25分钟。产品特点:
·快捷,简单的一步法高通量操作,无需纯化柱或过滤器,或重复移液、离心等操作(图 1)
·高结合能力
·极低的非特异性结合率
·成本低:只有市场同类磁珠产品价格的一半
·对样本体积要求低,便于自动化操作
缓冲液成分:
·GST Magnetic Beads (悬浮在 0.05 M Na2HPO4, pH 7.5, 0.15 M NaCl, 0.01% NaN3 缓冲液
中)
·1x Binding/Washing Buffer (0.14 M NaCl, 10 mM Na2HPO4, 1.8 mM KH2PO4, 2.7 mM KCl, pH 7.5)
·1x Elution Buffer (50 mM Tris-HCl, pH 8.0)
注意事项: Dissolve 100 mg Glutathione (reduced) in 10 ml of 1x Elution Buffer. Prepare fresh. ·PBS Buffer (137 mM NaCl, 2.7 mM KCl, 4.3 mM Na2HPO4, 1.4 mM KH2PO4, pH 7.5)
所需耗材
磁力分离器(适用于手动操作):根据实验时生物样品的体积,使用者可以选择一下不同
型号的磁力分离器:本公司 CZ402-01 可以容纳 8 个单独的 1.5 ml 离心管; CZ402-02 可
以容纳 24 个单独的 1.5 ml 离心管; CZ402-03 和 96 孔深孔板配合使用; CZ402-04 可以容
纳 4 个单独的 15 ml 离心管; CZ402-05 可以容纳 4 个单独的 50 ml 离心管。
操作过程
注意事项:
设计一个用于纯化 DNA 或 RNA 的通用操作流程相对简单,因为核酸具有相对一致
的生化特性。然而,设计一个用于蛋白质纯化的通用试剂盒是非常困难的,因为每种蛋白
质具有不同的组成和结构。为了获得最佳实验结果,每个用户必须确定需要纯化的融合蛋
白的最佳纯化条件。
在纯化 GST 标记的融合蛋白之前,应将所需使用的试剂温度调剂到室温。
A.细胞提取物的制备
1.将细胞培养液以 10000 x g 离心 6 分钟,完全去除上清后收集细胞体,并在-80℃下冷冻
放置 1 小时。
2. 在冰块上解冻细胞,并且每 50 毫升细胞培养物用 3ml 的 1x Binding/ Washing Buffer 重
新悬浮细胞。在冰上通过短暂的超声破碎细胞,直到样品不再粘稠。同时避免样品被加热。
注意:GST 标签与磁珠的结合不受 1% Triton X-100、1% Tween-20、1% CTAB、10 mM DTT、
0.03%SDS 或 0.1% NP-40 的影响。而且,这些化学物质可能会减少非特异性结合概率。
3. 以 10000 x g 离心6分钟,小心地将上清液转移到干净的预冷管中,并将沉淀按照每50ml
培养物加入 3ml 1x Binding /Wshing 缓冲液方式重新悬浮。
4. 分别从上清液和沉淀液中吸取 10μl 样品,加入等体积的 2x SDS 加样缓冲液, 煮沸 5
分钟,使用 SDS-PAGE 测定融合蛋白的总量和溶解度。
注意:如果 GST 融合蛋白形成包涵体(不溶性蛋白),则包涵体必须在纯化前适当溶解和
重新折叠。
B.在自然条件下纯化重组 GST 标签融合蛋白
1. 震荡装有磁珠的试剂瓶,直到磁珠完全悬浮,然后将适量的磁珠转移到新的试管中。
注意:这一点非常重要,用户应根据粗样品中 GST 标记融合蛋白的数量,根据经验确定
用于每次纯化的最佳磁珠数量。过多的磁珠会导致更高的背景;磁珠太少会导致产量下降。
所以,我们建议从每 0.1mg 重组 GST 标签融合蛋白加 100μl 完全悬浮磁珠开始纯化。
2. 将试管置于磁力分离器中,等待 2-3 分钟,直到上清液完全澄清。吸出上清液,从磁力
分离器上取下管,用 4 倍体积的 1x Binding /Wshing 缓冲液重新悬浮磁珠。
3.重复步骤 2 一次。
4. 将试管放入磁力分离器中,待上清液澄清后丢弃上清液。用 1 倍体积的 1xBinding
/Wshing 缓冲液重新悬浮磁珠。
5. 将制备好的细胞提取物与磁珠混合,通过多次颠倒充分混合,并在连续旋转的情况下混
匀 10-20 分钟。将试管放入磁力分离器中,保存一小部分上清液并丢弃剩余部分。
注意:保留一份上清液供进一步分析,因为某些蛋白质可能不会与磁珠结合。
6. 通过添加 8 倍体积的 1x Binding /Wshing 缓冲液清洗磁珠,并通过移液器多次吹吸重新
悬浮磁珠。再次将试管放入磁力分离器中,然后吸出试管上清液。
7. 用 8 倍体积的 1x Binding /Wshing 缓冲液充分清洗磁珠,直到洗脱液在 280 nm 处的
吸光度接近背景水平(OD 280<0.05)。(注意:这一步对于获得高纯度蛋白质非常重要。)
8. 从磁力分离器上取下试管,向试管中加入所需体积的 1x Elution Buffer 缓冲液,从磁珠
上洗脱下结合蛋白。通过多次吹吸,将磁珠重新充分悬浮,并在室温下涡旋震荡 5 分钟充
分混匀。将管放入磁力分离器中,小心地将上清液转移到干净的试管中。
9.重复步骤 8 一次。
10. 分别从上述步骤5 中吸取的上清液和步骤 8 中吸取的蛋白洗脱液中吸取 10-20μl 液体,
并进行 SDS-PAGE 分析,以确认目标蛋白的存在。
C.磁珠的再生和储存
注意:如果目标 GST 融合蛋白相同,则磁珠可重复使用三次而无需再生。但是,如果目
标 GST 融合蛋白不同或磁珠结合能力下降,则必须根据以下条件再生磁珠:
1. 使用 10 倍体积的再生缓冲液 I (50 mM Tris-HCl,pH 8.0, 0.5 M NaCl)清洗磁珠,并用上
述的磁力分离器分离上清液。
2. 使用 10 倍体积的再生缓冲液 II (100 mM 醋酸钠,pH 4.5, 0.5 M NaCl)清洗磁珠,并用
磁力分离器分离上清液。
3. 通过添加 10 倍体积的 1x Binding /Wshing 缓冲液,快速平衡磁珠。对于长期储存,磁
珠应储存在 4ºC 的 20%乙醇中。
D.常见问题
问题 1:纯化的融合蛋白产率低或无法检测到。
可能原因:
1. 重组蛋白形成包涵体
建议: ⑴在 14℃环境培养菌体。
⑵将 IPTG 的最终浓度降低至 0.1mM 以进行蛋白质诱导。 ⑶减少蛋白诱导时间。 ⑷纯化前正确破碎包涵体。
2. 该融合蛋白不含有活性 GST 标签
建议:尝试使用其他融合蛋白的纯化方式,例如 His 标签。重新编码目标蛋白的纯化标签。
3.过度的超声破碎,使蛋白变性。 建议:尽量使用温和的超声波条件或其他方法,如溶菌
酶。
4.融合蛋白不与磁珠结合
建议: ⑴在细胞裂解之前,在结合缓冲液中添加最终浓度为 5 mM 的 DTT。 ⑵ 检查结合缓冲液的 pH 值(pH 值应为 6.5-8.0)。
5. 融合蛋白不能有效地从磁珠中洗脱。
建议: ⑴提高洗脱时间。 ⑵将洗脱缓冲液中的谷胱甘肽浓度增加至 15mM 或更高。(请检查最终 pH 值,必要时
进行调整。)
⑶在不增加谷胱甘肽浓度的情况下,将洗脱缓冲液的 pH 值调整至 8.0-9.0。 ⑷在洗脱缓冲液中添加最终浓度为 0.1% Triton X-100 或最终浓度为 0.1-0.2 M NaCl。
问题 2. 在洗脱蛋白中观察到多条带
可能原因:
1.融合蛋白降解
建议: ⑴添加适量的蛋白酶抑制剂。 ⑵使用蛋白酶缺陷表达宿主。
2. 一些宿主蛋白,如伴侣蛋白,可能与融合蛋白相互作用。
建议: ⑴在洗脱缓冲液中加入最终浓度为 5 mM DTT。 ⑵纯化前,在 37℃下将重组蛋白溶液在伴侣蛋白缓冲液(2 mM ATP、10 mM MgSO4、50 mM Tris-HCl)中温浴 10 min。
3. 过度超声处理会导致一些蛋白质与融合蛋白结合。