细胞实验要点:怎样检测细胞衰老?
细胞衰老是细胞在正常环境条件下发生的功能减退、逐渐趋向死亡的现象。众所周知,衰老的细胞表现为细胞体积变大,呈扁平状;细胞核变大,核膜内陷,染色质聚集、固缩、裂解;胞质内颗粒增加,有空泡形成;线粒体的数目及形状发生改变;膜流动性降低;溶酶体内容物增多,导致溶酶体酶β-半乳糖苷酶活性升高。衰老细胞所具有的上述特征成为各种细胞衰老检测手段的依据。
其中,对衰老相关β-半乳糖苷酶的检测是有效检测细胞衰老的经典方法。X-Gal(5-溴-4-氯-3-吲哚-β-D-半乳糖苷)是β-半乳糖苷酶的底物,X-Gal本身无色,经β-半乳糖苷酶水解后产生半乳糖和蓝色的5-溴-4-氯-靛蓝。利用X-Gal的这个特点,可以间接对β-半乳糖苷酶的活性进行测定。衰老细胞中的溶酶体内容物通常增多,使得溶酶体酶β-半乳糖苷酶的活性升高,故可以X-Gal作为底物对细胞衰老的情况进行检测。
细胞衰老检测方法图表:
可以通过衰老细胞的标志物来检测衰老细胞。常见的检测方法有细胞染色,Western blot,PCR 和 ELISA 等。
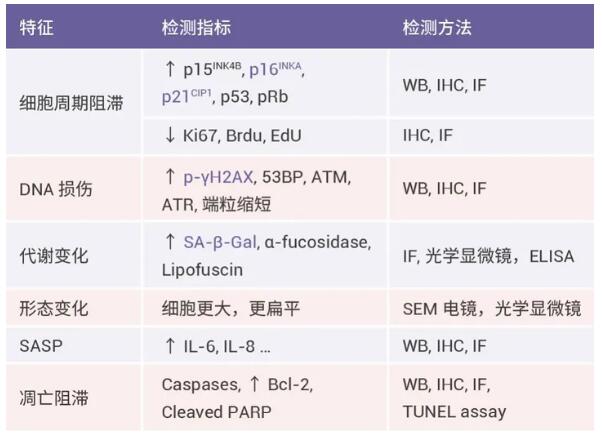
细胞衰老检测方法与步骤:
(1)、细胞接种前在6孔培养板中预先放置灭菌的细胞片,每孔加入1×10E5个细胞,37℃ 5% CO2条件下培养过夜,使细胞在细胞片上生长。
(2)、在超净工作台中吸弃6孔培养板中的培养液,加入×1 PBS,洗涤细胞1次,随后加入2%甲醛/0.2%C5H8O2固定液,室温条件下固定3~5分钟。
(3)、吸弃2%甲醛/0.2%C5H8O2固定液,加入×1 PBS,洗涤细胞3次,每次3分钟。
(4)、吸弃×1 PBS,加X-Gal溶液以浸没细胞片为宜,37℃孵育4~8小时或过夜,用保鲜膜包被6孔培养板以防染液蒸发。
(5)、取出细胞爬片,去离子水冲洗2次,再次用固定液固定4分钟,流水轻轻冲洗。
(6)、将细胞爬片按此顺序脱水、透明∶95%酒精I(2分钟)→95%酒精Ⅱ(2分钟)→100%酒精I(2分钟)→100%酒精I(5分钟)→C8H10I(2分钟)→C8H10Ⅱ(2分钟)。
(7)、中性树胶封片。
(8)、在普通光学显微镜下观察衰老细胞形态。
每张片子镜下计数400个细胞,确定X-Gal染色阳性细胞(衰老细胞)在细胞群体中的所占的百分比即衰老细胞率(蓝染细胞数/总计细胞数×100%)。
细胞衰老检测注意事项:
(1)、X-Gal溶液需要现用现配。
(2)、细胞固定时间过长或固定之后清洗不干净,均会影响后续的酶反应。




